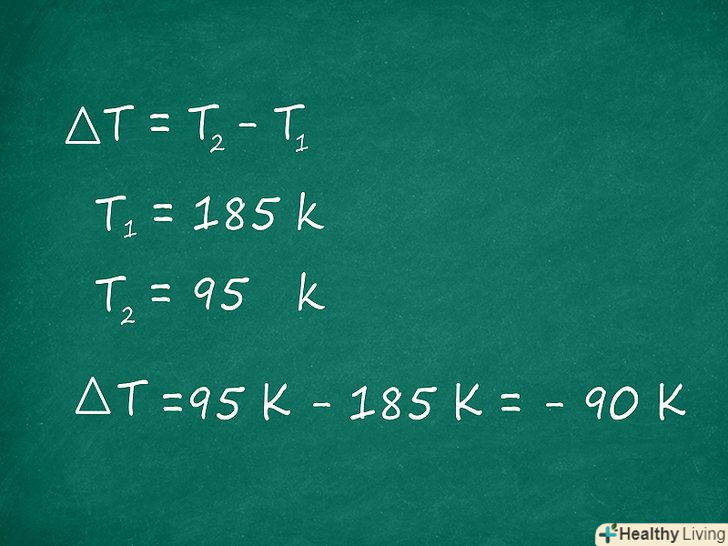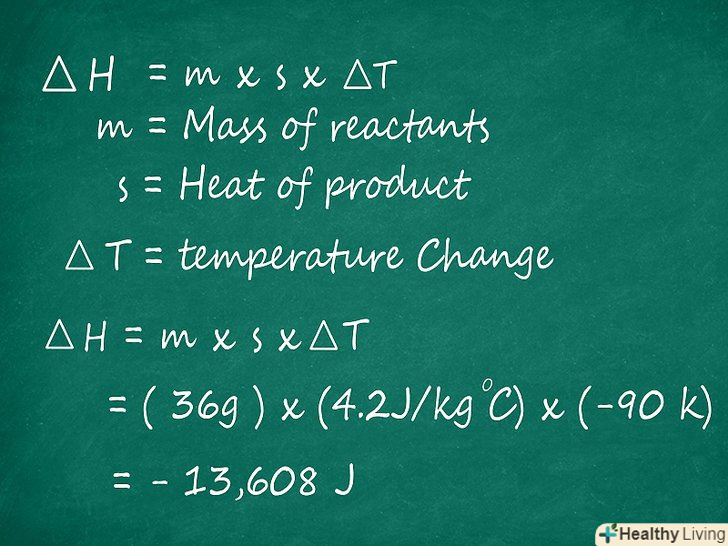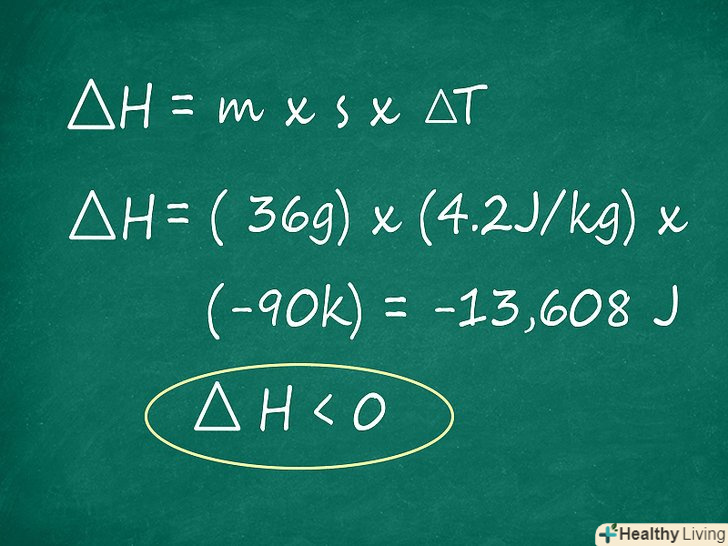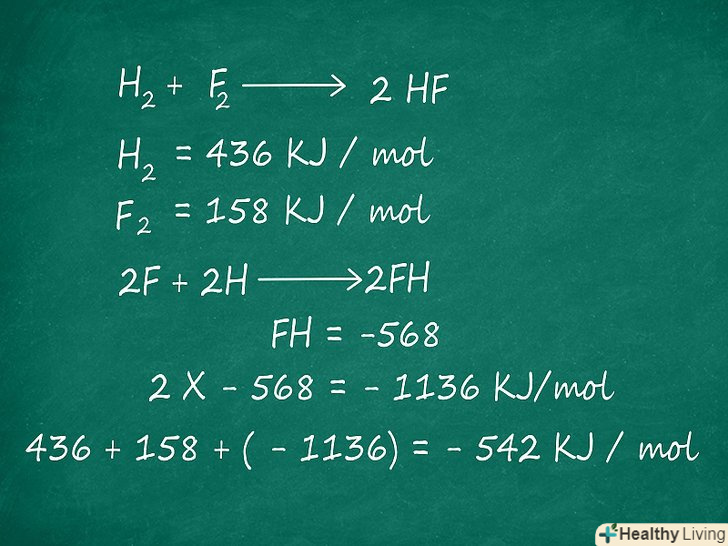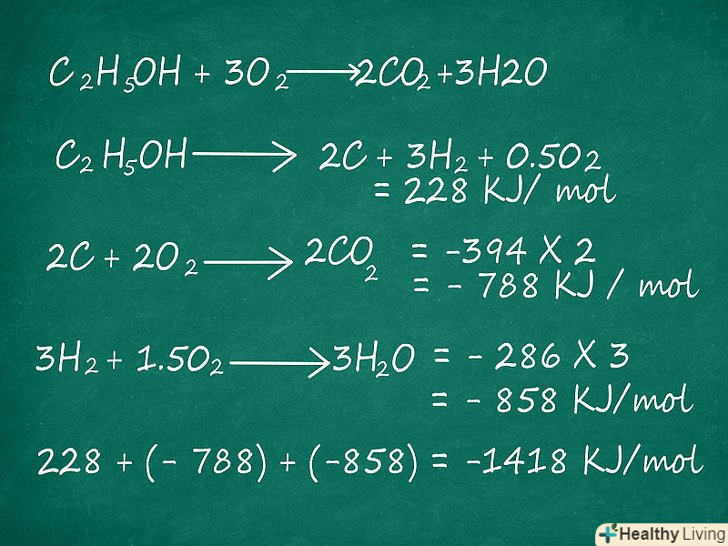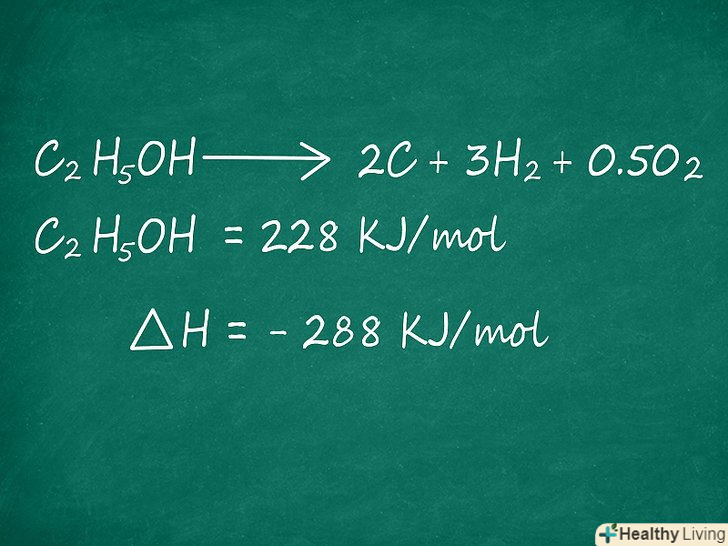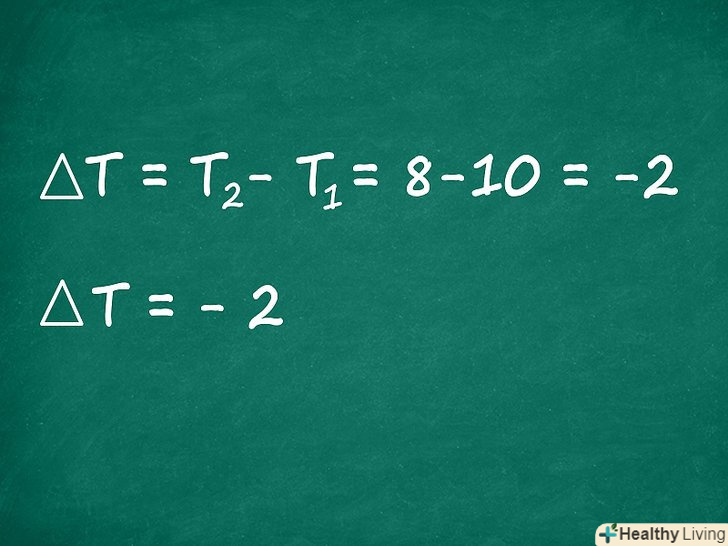Під час хімічних реакцій відбувається поглинання або виділення тепла в навколишнє середовище. Такий теплообмін між хімічною реакцією і навколишнім середовищем називається ентальпією, або H. однак виміряти ентальпію безпосередньо неможливо, тому прийнято розраховувати зміна температури навколишнього середовища (позначається ∆H). ∆H показує, що в ході хімічної реакції відбувається виділення тепла в навколишнє середовище (екзотермічна реакція) або поглинання тепла (ендотермічна реакція). Розраховується ентальпія так:∆H = M x s x ∆T, де m — маса реагентів, s — теплоємність продукту реакції, ∆T — зміна температури в результаті реакції.
Кроки
Метод1З 3:
Рішення задач на ентальпію
Метод1З 3:
 Визначте реагенти та продукти реакції.будь-яка хімічна реакція має реагенти і продукти реакції. Продукт реакції створюється в результаті взаємодії реагентів. Іншими словами реагенти-це інгредієнти в рецепті, а продукт реакції — це готову страву. Щоб знайти ∆H реакції, необхідно знати реагенти і продукти реакції.
Визначте реагенти та продукти реакції.будь-яка хімічна реакція має реагенти і продукти реакції. Продукт реакції створюється в результаті взаємодії реагентів. Іншими словами реагенти-це інгредієнти в рецепті, а продукт реакції — це готову страву. Щоб знайти ∆H реакції, необхідно знати реагенти і продукти реакції.- Наприклад, необхідно знайти ентальпію реакції утворення води з водню і кисню: 2h2 (водень) + O2 (кисень) → 2h2O (вода). У цій реакції H2і O2 – реагенти, А H2 O — продукт реакції.
 Визначте загальну масу реагентів. Далі необхідно підрахувати масу реагентів. Якщо ви не можете зважити їх, то підрахуйте молекулярну масу, щоб знайти фактичну. Молекулярна маса-це постійна, яку можна знайти в періодичній таблиці Менделєєва або в інших таблицях молекул і сполук. Помножте масу кожного реагенту на число молей.
Визначте загальну масу реагентів. Далі необхідно підрахувати масу реагентів. Якщо ви не можете зважити їх, то підрахуйте молекулярну масу, щоб знайти фактичну. Молекулярна маса-це постійна, яку можна знайти в періодичній таблиці Менделєєва або в інших таблицях молекул і сполук. Помножте масу кожного реагенту на число молей.- У нашому прикладі реагенти водень і кисень мають молекулярні маси 2 г і 32 г відповідно. Оскільки ми використовуємо 2 моль водню (коефіцієнт в хімічній реакції перед воднем h2) і 1 моль кисню (відсутність коефіцієнта перед O2 позначає 1 моль), то загальна маса реагентів розраховується наступним чином:
2 х (2 г) + 1 х (32 г) = 4 Г + 32 г = 36 г
- У нашому прикладі реагенти водень і кисень мають молекулярні маси 2 г і 32 г відповідно. Оскільки ми використовуємо 2 моль водню (коефіцієнт в хімічній реакції перед воднем h2) і 1 моль кисню (відсутність коефіцієнта перед O2 позначає 1 моль), то загальна маса реагентів розраховується наступним чином:
 Визначте теплоємність продукту. Далі визначте теплоємність продукту реакції. Кожна молекула має певну величину теплоємності, яка є постійною. Знайдіть цю постійну в таблицях підручника з хімії. Існує кілька одиниць вимірювання теплоємності; в наших розрахунках ми будемо використовувати Дж/г°C.
Визначте теплоємність продукту. Далі визначте теплоємність продукту реакції. Кожна молекула має певну величину теплоємності, яка є постійною. Знайдіть цю постійну в таблицях підручника з хімії. Існує кілька одиниць вимірювання теплоємності; в наших розрахунках ми будемо використовувати Дж/г°C.- Зверніть увагу на те, що при наявності декількох продуктів реакції вам буде потрібно розрахувати теплоємність кожного, а потім скласти їх, щоб отримати ентальпію всієї реакції.
- У нашому прикладі, продукт реакції-вода, яка має теплоємність4,2 Дж/г°c.
 Знайдіть зміну температури. Тепер ми знайдемо ∆t-різницю температур до і після реакції. З початкової температури (T1) відніміть кінцеву температуру (T2). Найчастіше в задачах з хімії використовується шкала Кельвіна (К) (хоча за шкалою Цельсія (°С) вийде той же результат).
Знайдіть зміну температури. Тепер ми знайдемо ∆t-різницю температур до і після реакції. З початкової температури (T1) відніміть кінцеву температуру (T2). Найчастіше в задачах з хімії використовується шкала Кельвіна (К) (хоча за шкалою Цельсія (°С) вийде той же результат).- У нашому прикладі давайте припустимо, що початкова температура реакції була 185 K, а після реакції стала 95 K, значить, ∆T обчислюється так:
∆T = T2-T1 = 95 K - 185 K = -90 k
- У нашому прикладі давайте припустимо, що початкова температура реакції була 185 K, а після реакції стала 95 K, значить, ∆T обчислюється так:
 Знайдіть ентальпію за формулою ∆H =m xs x ∆T. якщо відома m — маса реагентів, s — теплоємність продукту реакції і ∆T — зміна температури, то можна підрахувати ентальпію реакції. Підставте значення в формулу ∆H = mx s x ∆T і отримаєте ентальпію. Результат обчислюється в Джоулях (Дж).
Знайдіть ентальпію за формулою ∆H =m xs x ∆T. якщо відома m — маса реагентів, s — теплоємність продукту реакції і ∆T — зміна температури, то можна підрахувати ентальпію реакції. Підставте значення в формулу ∆H = mx s x ∆T і отримаєте ентальпію. Результат обчислюється в Джоулях (Дж).- У нашому прикладі ентальпія обчислюється так:
∆H = (36 г) x (4,2 ДжК - 1 г - 1) x (-90 K) = -13608 Дж
- У нашому прикладі ентальпія обчислюється так:
 Визначте, виділяється або поглинається енергія в ході даної реакції. Одна з найпоширеніших причин, по якій потрібно обчислити ∆H на практиці, — дізнатися, чи реакція екзотермічної (виділення тепла і зниження власної енергії) або ендотермічний (поглинання тепла з навколишнього середовища і підвищення власної енергії). Якщо значення ∆H позитивне, значить, реакція ендотермічна. Якщо негативне, значить, реакція екзотермічна. Чим більше абсолютне значення ∆h, тим більше енергії виділяється або поглинається. Будьте обережні, якщо збираєтеся проводити практичний досвід: під час реакцій з високим значенням ентальпії може відбутися велике вивільнення енергії, і якщо воно протікає швидко, то може привести до вибуху.
Визначте, виділяється або поглинається енергія в ході даної реакції. Одна з найпоширеніших причин, по якій потрібно обчислити ∆H на практиці, — дізнатися, чи реакція екзотермічної (виділення тепла і зниження власної енергії) або ендотермічний (поглинання тепла з навколишнього середовища і підвищення власної енергії). Якщо значення ∆H позитивне, значить, реакція ендотермічна. Якщо негативне, значить, реакція екзотермічна. Чим більше абсолютне значення ∆h, тим більше енергії виділяється або поглинається. Будьте обережні, якщо збираєтеся проводити практичний досвід: під час реакцій з високим значенням ентальпії може відбутися велике вивільнення енергії, і якщо воно протікає швидко, то може привести до вибуху.- У нашому прикладі кінцевий результат вийшов рівним -13608 Дж. Перед значенням ентальпії негативний знак, а це означає, що реакціяЕкзотермічна. Гарячі гази (у вигляді пари) h2 і O2 повинні виділити деяку кількість тепла, щоб утворити молекулу води, тобто реакція утворення H2O є екзотермічною.
Метод2 З 3:
Оцінка ентальпії
Метод2 З 3:
 Підрахуйте енергію зв'язків для оцінки ентальпії.майже всі хімічні реакції призводять до розриву одних зв'язків і утворення інших. Енергія в результаті реакції не виникає нізвідки і не руйнується: це та енергія, яка потрібна для розриву або утворення цих зв'язків. Тому зміна ентальпії всієї реакції можна досить точно оцінити шляхом підсумовування енергії цих зв'язків.
Підрахуйте енергію зв'язків для оцінки ентальпії.майже всі хімічні реакції призводять до розриву одних зв'язків і утворення інших. Енергія в результаті реакції не виникає нізвідки і не руйнується: це та енергія, яка потрібна для розриву або утворення цих зв'язків. Тому зміна ентальпії всієї реакції можна досить точно оцінити шляхом підсумовування енергії цих зв'язків.- Наприклад, розглянемо реакцію: H 2 + F 2 → 2HF. У цьому випадку, енергія для розриву зв'язку в молекулі h2 становить 436 кДж/моль, а енергія для розриву F2 становить 158 кДж / моль.[1] нарешті, енергія необхідна для утворення зв'язку в молекулі HF з H і F = -568 кДж/моль.[2] множимо останнє значення на 2, так як в ході реакції отримуємо 2 моль HF: 2 x -568 = -1136 кДж / моль. Складаємо значення:
436 + 158 + (-1136) = -542 кДж/моль.
- Наприклад, розглянемо реакцію: H 2 + F 2 → 2HF. У цьому випадку, енергія для розриву зв'язку в молекулі h2 становить 436 кДж/моль, а енергія для розриву F2 становить 158 кДж / моль.[1] нарешті, енергія необхідна для утворення зв'язку в молекулі HF з H і F = -568 кДж/моль.[2] множимо останнє значення на 2, так як в ході реакції отримуємо 2 моль HF: 2 x -568 = -1136 кДж / моль. Складаємо значення:
 Використовуйте ентальпію освіти для оцінки ентальпії. Ентальпія освіти дозволяє розрахувати ∆H через обчислення реакцій утворення реагентів і продуктів. Якщо відома ентальпія утворення продуктів реакції і реагентів, то ви можете оцінити ентальпію в цілому шляхом додавання, як і в разі енергії, розглянутому вище.
Використовуйте ентальпію освіти для оцінки ентальпії. Ентальпія освіти дозволяє розрахувати ∆H через обчислення реакцій утворення реагентів і продуктів. Якщо відома ентальпія утворення продуктів реакції і реагентів, то ви можете оцінити ентальпію в цілому шляхом додавання, як і в разі енергії, розглянутому вище.- Наприклад, розглянемо наступну реакцію: c2H5OH + 3o2 → 2CO2 + 3h2O. ми знаємо, що ентальпія освіти розраховується:[3]
C2H5OH → 2C + 3H2 + 0,5 O2 = 228 кДж/моль
2C + 2O2 → 2CO2 = -394 × 2 = -788 кДж/моль
3H2 + 1.5 O2 → 3H2O = -286 × 3 = -858 кДж/моль
Тепер необхідно скласти значення утворених речовин, отримані вище, для визначення ентальпії реакції: C2H5OH + 3O2 → 2CO2 + 3H2O,
228 + -788 + -858 = -1418 кДж/моль.
- Наприклад, розглянемо наступну реакцію: c2H5OH + 3o2 → 2CO2 + 3h2O. ми знаємо, що ентальпія освіти розраховується:[3]
 Не забувайте про Знаки перед значеннями ентальпії. при обчисленні ентальпії освіти формулу для визначення ентальпії реакції продукту ви перевертаєте, і знак ентальпії повинен помінятися. Іншими словами, якщо ви перевертаєте формулу, то знак ентальпії повинен змінитися на протилежний.
Не забувайте про Знаки перед значеннями ентальпії. при обчисленні ентальпії освіти формулу для визначення ентальпії реакції продукту ви перевертаєте, і знак ентальпії повинен помінятися. Іншими словами, якщо ви перевертаєте формулу, то знак ентальпії повинен змінитися на протилежний.- У прикладі зверніть увагу на те, що реакція утворення для продукту c2H5OH записана навпаки. C2H5OH → 2C + 3h2 + 0,5 O2 тобто C2H5OH розпадається, а не синтезується. Тому знак перед ентальпією в такій реакції позитивний, 228 кДж / моль, хоча ентальпія утворення c2H5OH становить -228 кДж/моль.
Метод3 З 3:
Спостереження ентальпії в ході експерименту
Метод3 З 3:
 Візьміть чисту ємність і налийте туди води.побачити принципи ентальпії в дії неважко-досить провести простий досвід. Необхідно, щоб на результат експерименту не вплинули сторонні забруднювачі, так що ємність потрібно вимити і простерилізувати. Вчені для вимірювання ентальпії використовують спеціальний закриті контейнери-калориметри, але вам цілком підійде скляний стакан або колба. Заповніть ємність чистою водопровідною водою кімнатної температури. Бажано проводити експеримент в прохолодному приміщенні.
Візьміть чисту ємність і налийте туди води.побачити принципи ентальпії в дії неважко-досить провести простий досвід. Необхідно, щоб на результат експерименту не вплинули сторонні забруднювачі, так що ємність потрібно вимити і простерилізувати. Вчені для вимірювання ентальпії використовують спеціальний закриті контейнери-калориметри, але вам цілком підійде скляний стакан або колба. Заповніть ємність чистою водопровідною водою кімнатної температури. Бажано проводити експеримент в прохолодному приміщенні.- Для експерименту бажано використовувати невелику ємність. Ми будемо розглядати ентальпію реакції води з "Алка-Зельтцер", тому, чим менше води використовується, тим більш очевидним буде зміна температури.
 Помістіть термометр в ємність.Візьміть термометр і опустіть його в ємність з водою так, щоб межа прочитання температури була нижче рівня води. Зніміть показання термометра-це буде початкова температура, T1.
Помістіть термометр в ємність.Візьміть термометр і опустіть його в ємність з водою так, щоб межа прочитання температури була нижче рівня води. Зніміть показання термометра-це буде початкова температура, T1.- Припустимо, що температура води становить 10 °C. ми будемо використовувати це значення для демонстрації принципів ентальпії.
 Додайте в ємність одну таблетку "Алка-зельтцер". Готові почати досвід? Киньте в воду одну таблетку "Алка-зельтцер". Вона відразу почне пузиритися і шипіти. Це відбувається через реакцію між бікарбонатом (HCO3-) і лимонною кислотою (H+). В результаті утворюються вода і вуглекислий газ за формулою: 3hco3− + 3h+ → 3h2O + 3co2.
Додайте в ємність одну таблетку "Алка-зельтцер". Готові почати досвід? Киньте в воду одну таблетку "Алка-зельтцер". Вона відразу почне пузиритися і шипіти. Це відбувається через реакцію між бікарбонатом (HCO3-) і лимонною кислотою (H+). В результаті утворюються вода і вуглекислий газ за формулою: 3hco3− + 3h+ → 3h2O + 3co2. Виміряйте кінцеву температуру.спостерігайте за ходом реакції: таблетка "Алка-зельтцер" буде поступово розчинятися. Коли вона розчиниться повністю, виміряйте температуру ще раз. Вода повинна стати трохи холодніше. Якщо температура води навпаки стала вище початкової, значить, експерименту завадили якісь зовнішні фактори (наприклад, занадто тепле приміщення, де проводився експеримент).
Виміряйте кінцеву температуру.спостерігайте за ходом реакції: таблетка "Алка-зельтцер" буде поступово розчинятися. Коли вона розчиниться повністю, виміряйте температуру ще раз. Вода повинна стати трохи холодніше. Якщо температура води навпаки стала вище початкової, значить, експерименту завадили якісь зовнішні фактори (наприклад, занадто тепле приміщення, де проводився експеримент).- Припустимо, що температура становить тепер 8 °C.
 Підрахуємо ентальпію реакції.коли таблетка "Алка-зельтцер" вступає в реакцію з водою, утворюються вода і вуглекислий газ (ті самі шипучі бульбашки) і відбувається зниження температури (це той результат, який повинен вийти, якщо досвід пройшов успішно). Можна зробити висновок, що дана хімічна реакція є ендотермічної, тобто вона супроводжується поглинанням енергії з навколишнього середовища — в даному випадку з води. В результаті температура води знижується.
Підрахуємо ентальпію реакції.коли таблетка "Алка-зельтцер" вступає в реакцію з водою, утворюються вода і вуглекислий газ (ті самі шипучі бульбашки) і відбувається зниження температури (це той результат, який повинен вийти, якщо досвід пройшов успішно). Можна зробити висновок, що дана хімічна реакція є ендотермічної, тобто вона супроводжується поглинанням енергії з навколишнього середовища — в даному випадку з води. В результаті температура води знижується.- У нашому експерименті температура води знизилася на два градуси. Це узгоджується з теорією: реакція розчинення "Алка-зельтцер" у воді ендотермічна і супроводжується невеликим поглинанням енергії.
Поради
- У підрахунках використовується шкала Кельвіна — K) - це температурна шкала, аналогічна шкалі Цельсія, і часто застосовується в хімії і фізиці. Щоб перевести значення градусів Цельсія в кельвіни, необхідно додати або відняти 273 градуси: K = °C + 273.
Джерела
- ↑ Http://www.science.uwaterloo.ca/~cchieh/cact/c120/heatreac.html
- ↑ Http://www.science.uwaterloo.ca/~cchieh/cact/c120/heatreac.html
- ↑ Http://www.science.uwaterloo.ca/~cchieh/cact/c120/heatreac.html
- Http://www.science.uwaterloo.ca/~cchieh/cact/c120/heatreac.html
- Http://www.science.uwaterloo.ca/~cchieh/cact/c120/chemener.html#enthalpy
- Http://www.iun.edu/~cpanhd/C101webnotes/matter-and-energy/specificheat.html
- Http://education.seattlepi.com/delta-h-represent-chemistry-3557.html
- Https://www.chem.tamu.edu/class/majors/tutorialnotefiles/enthalpy.htm
- Http://www.pasco.com/chemistry/experiments/online/classic-endothermic-reaction-alka-seltzer-and-water.cfm