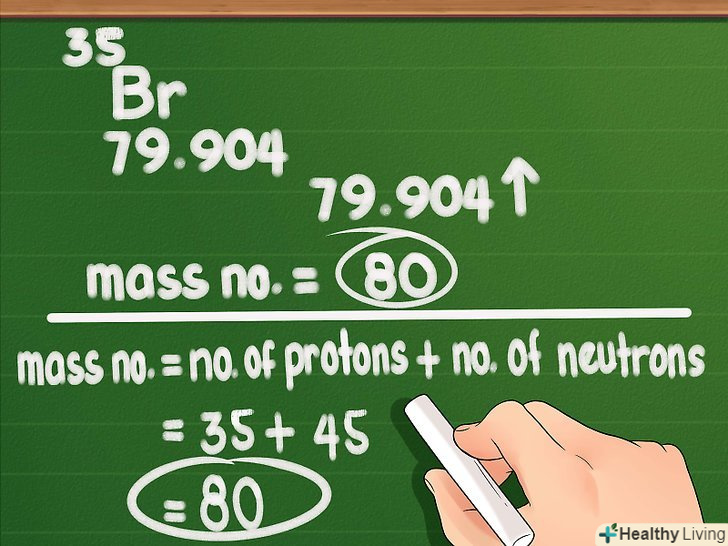Атомний номер елемента-це число протонів в ядрі одного атома цього елемента. Атомний номер елемента або ізотопу залишається постійним, тому з його допомогою можна дізнатися інші величини, наприклад, кількість електронів і нейтронів в атомі.
Кроки
Частина1 З 2:
Як дізнатися атомний номер
Частина1 З 2:
 Знайдіть періодичну систему хімічних елементів (таблицю Менделєєва). якщо хочете, скористайтеся таблицею в цій статті. У кожного елемента свій атомний номер, а елементи в таблиці впорядковані за атомними номерами. Знайдіть таблицю Менделєєва або просто запам'ятайте її.
Знайдіть періодичну систему хімічних елементів (таблицю Менделєєва). якщо хочете, скористайтеся таблицею в цій статті. У кожного елемента свій атомний номер, а елементи в таблиці впорядковані за атомними номерами. Знайдіть таблицю Менделєєва або просто запам'ятайте її.- Таблицю Менделєєва можна знайти в більшості підручників з хімії.
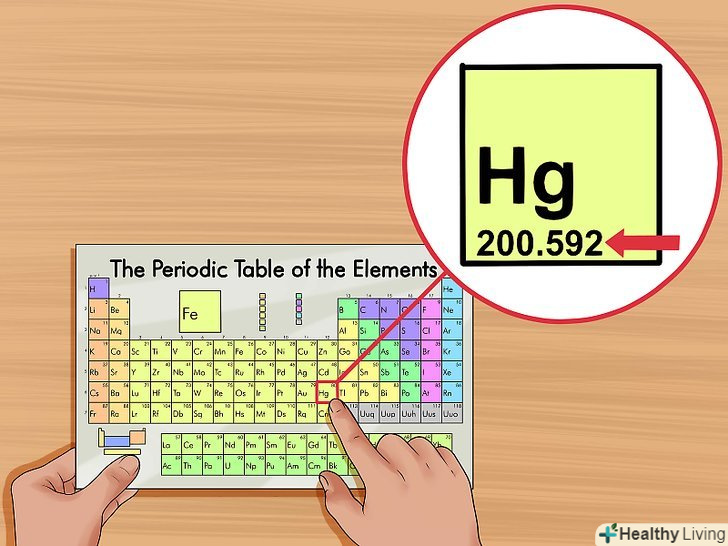
 Знайдіть потрібний елемент.у таблиці наводиться повна назва елемента і його хімічний символ (наприклад, Hg для ртуті). Якщо у вас не виходить знайти елемент, в пошуковій системі введіть " хімічний символ &#lt;назва елемента&#gt;".
Знайдіть потрібний елемент.у таблиці наводиться повна назва елемента і його хімічний символ (наприклад, Hg для ртуті). Якщо у вас не виходить знайти елемент, в пошуковій системі введіть " хімічний символ &#lt;назва елемента&#gt;". Знайдіть атомний номер.як правило, він знаходиться у верхньому лівому або верхньому правому куті комірки елемента, але може бути і в іншому місці. Атомний номер завжди виражений цілим числом.
Знайдіть атомний номер.як правило, він знаходиться у верхньому лівому або верхньому правому куті комірки елемента, але може бути і в іншому місці. Атомний номер завжди виражений цілим числом.- Якщо ви бачите десятковий дріб, це атомна маса.
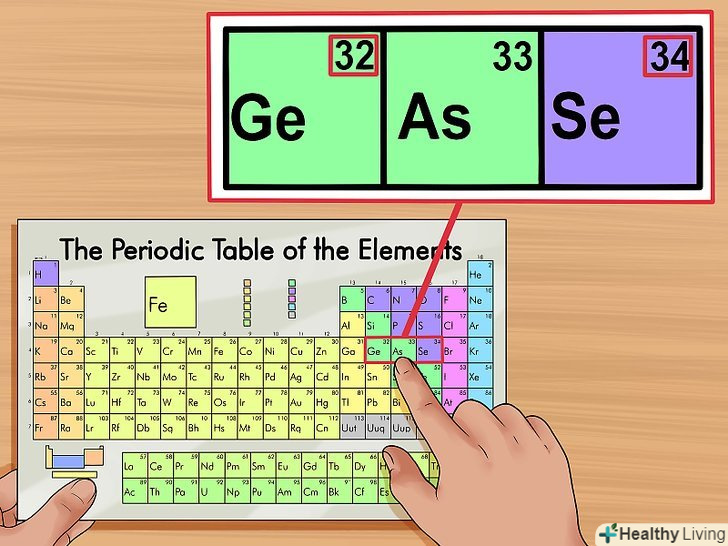
 Переконайтеся, що знайшли атомний номер. елементи таблиці впорядковані за зростанням атомних номерів. Якщо атомний номер потрібного елемента дорівнює "33«, то атомний номер попереднього елемента повинен бути рівний» 32«, а наступного елемента — »34". Якщо це так, ви знайшли атомний номер.
Переконайтеся, що знайшли атомний номер. елементи таблиці впорядковані за зростанням атомних номерів. Якщо атомний номер потрібного елемента дорівнює "33«, то атомний номер попереднього елемента повинен бути рівний» 32«, а наступного елемента — »34". Якщо це так, ви знайшли атомний номер.- Іноді таблиця виглядає так, що після барію (56) і радію (88) є порожні осередки. Насправді вони не порожні-відповідні елементи розташовані внизу таблиці. Це зроблено для того, щоб записати таблицю в певній формі.
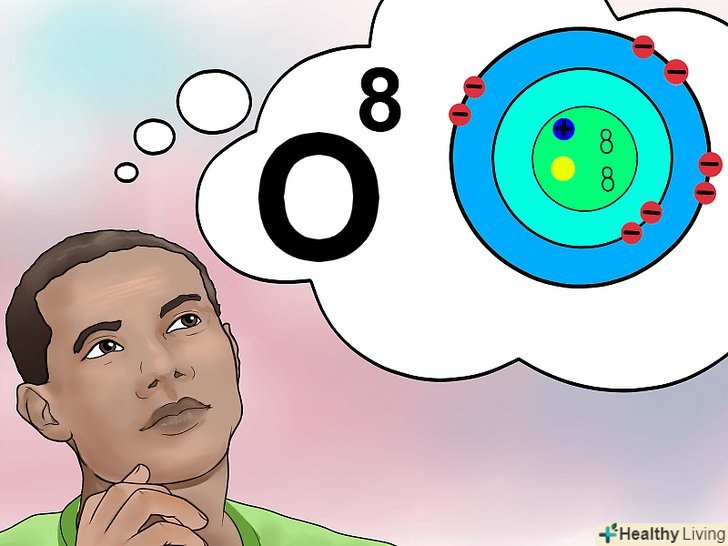
 Запам'ятайте, що таке атомний номер.атомний номер-це число протонів в ядрі одного атома елемента.[1] це фундаментальна величина, що характеризує елемент. Кількість протонів визначає загальний електричний заряд ядра, який вказує на число електронів, що обертаються навколо атома. Оскільки електрони беруть участь майже у всіх хімічних взаємодіях, атомний номер побічно встановлює більшість фізичних і хімічних властивостей елемента.
Запам'ятайте, що таке атомний номер.атомний номер-це число протонів в ядрі одного атома елемента.[1] це фундаментальна величина, що характеризує елемент. Кількість протонів визначає загальний електричний заряд ядра, який вказує на число електронів, що обертаються навколо атома. Оскільки електрони беруть участь майже у всіх хімічних взаємодіях, атомний номер побічно встановлює більшість фізичних і хімічних властивостей елемента.- Іншими словами, будь-який атом з вісьмома протонами є атомом кисню. Два атоми кисню можуть мати різну кількість нейтронів або електронів (якщо один з атомів є іоном), але у них завжди буде по вісім протонів.
Частина2 З 2:
Як знайти іншу інформацію
Частина2 З 2:
 З'ясуйте атомну вагу.у таблиці атомна вага знаходиться під назвою елемента і являє собою десятковий дріб з двома або трьома знаками після десяткової коми. Атомна вага-це середня маса одного атома елемента по відношенню до маси елемента, який знаходиться в природі. Атомна вага вимірюється в " атомних одиницях маси "(а.е.м.).
З'ясуйте атомну вагу.у таблиці атомна вага знаходиться під назвою елемента і являє собою десятковий дріб з двома або трьома знаками після десяткової коми. Атомна вага-це середня маса одного атома елемента по відношенню до маси елемента, який знаходиться в природі. Атомна вага вимірюється в " атомних одиницях маси "(а.е.м.).- У деяких підручниках і статтях атомна вага називається "відносною атомною масою".[2]
 Округлити атомну вагу, щоб знайти масове число.масове число-це загальна кількість протонів і нейтронів в одному атомі елемента. Це число легко знайти: подивіться в таблиці атомну вагу і округлите його до найближчого цілого числа. [3]
Округлити атомну вагу, щоб знайти масове число.масове число-це загальна кількість протонів і нейтронів в одному атомі елемента. Це число легко знайти: подивіться в таблиці атомну вагу і округлите його до найближчого цілого числа. [3]- Цей метод працює, тому що атомна вага нейтронів і протонів приблизно дорівнює 1 а.е.м., а атомна вага електронів приблизно дорівнює 0 А.е.М. атомна вага вимірюється досить точно, тому в ньому присутні цифри після десяткової коми, але нас цікавить тільки ціле число, яке дозволить дізнатися кількість протонів і нейтронів.
- Пам'ятайте, що атомна вага являє собою усереднене значення. Наприклад, середнє масове число брому дорівнює 80, але, як виявилося, масове число одного атома брому практично завжди дорівнює 79 або 81.[4]
- Знайдіть кількість електронів.атом складається з однакової кількості протонів і електронів, тому число електронів дорівнює числу протонів. Електрони заряджені негативно, тому вони врівноважують і нейтралізують протони, які заряджені позитивно.[5]
- Якщо атом втрачає або набуває електрони, він перетворюється в іон, тобто стає електрично зарядженим атомом.
 Знайдіть кількість нейтронів.Так як атомний номер = кількість протонів, а масове число = кількість протонів + кількість нейтронів, то число нейтронів = масове число-атомний номер. Ось пара прикладів:
Знайдіть кількість нейтронів.Так як атомний номер = кількість протонів, а масове число = кількість протонів + кількість нейтронів, то число нейтронів = масове число-атомний номер. Ось пара прикладів:- Один атом гелію (He) має масове число 4 і атомний номер 2. Тому в ньому 4 - 2 = 2 нейтрона.
- Атом срібла (Ag) має середнє масове число 108 (з таблиці Менделєєва) і атомний номер 47. Тому в атомі срібла 108 - 47 = 61 нейтрон.
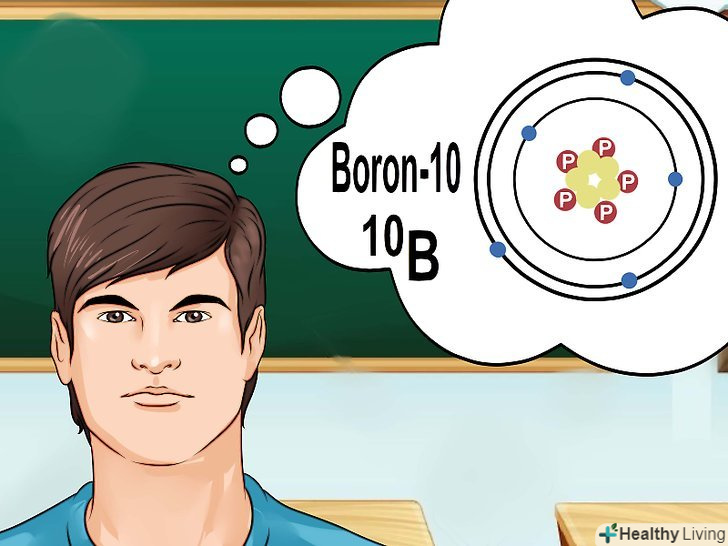
 Запам'ятайте, що таке ізотопи.ізотоп-це різновид атома з певною кількістю нейтронів. Якщо в хімічній задачі згадується» Бор-10 " або 10B, мова йде про елементи бору з масовим числом 10.[6] Використовуйте це масове число замість масового числа бора з таблиці Менделєєва.
Запам'ятайте, що таке ізотопи.ізотоп-це різновид атома з певною кількістю нейтронів. Якщо в хімічній задачі згадується» Бор-10 " або 10B, мова йде про елементи бору з масовим числом 10.[6] Використовуйте це масове число замість масового числа бора з таблиці Менделєєва.- Атомний номер ізотопів ніколи не змінюється. Ізотоп елемента має таку ж кількість протонів, як і сам елемент.
Поради
- Атомна вага важких елементів наводиться в дужках. Це означає, що атомна вага обчислюється на основі найбільш стабільного ізотопу, а не середнього числа декількох ізотопів.[7] (це не впливає на атомний номер елемента.)
Джерела
- ↑ Https://www.nde-ed.org/EducationResources/HighSchool/Radiography/atomicmassnumber.htm
- ↑ Http://www.degruyter.com/view/j/pac.1992.64.issue-10/pac199264101535/pac199264101535.xml
- ↑ Http://education.jlab.org/qa/pen_number.html
- ↑ http://www.webelements.com/bromine/isotopes.html
- ↑ Https://education.jlab.org/qa/pen_number.html
- ↑ Http://preparatorychemistry.com/Bishop_Isotope_Notation.htm
- ↑ Http://www.chemicalelements.com/sup/help.html